Au apărut zeci de medicamente antiobezitate și antidiabet pe piață, au provocat o adevărată modă, inclusiv în România. Apar însă și unele probleme…
Autoritățile europene de reglementare (AEM – Agenția Europeană pentru Medicamente) au declarat marți că au extins o investigație începută săptămâna trecută privind riscul de gânduri sinucigașe în rândul pacienților care iau medicamente populare pentru pierderea în greutate, precum Ozempic, pentru a include mai multe cazuri potențiale și alte medicamente din această clasă.
Cazuri de autoagresiune și gânduri sinucigașe
Agenția Europeană pentru Medicamente evaluează în prezent aproximativ 150 de rapoarte privind posibile cazuri de autoagresiune și gânduri sinucigașe, a precizat marți autoritatea de reglementare într-o declarație.
Luni, autoritatea de reglementare a declarat pentru CNN că a deschis o investigație după raportarea a trei cazuri de gânduri sinucigașe și gânduri de automutilare semnalate de către Agenția pentru medicamente din Islanda.
EMA a declarat că nu este încă clar dacă medicamentele au cauzat aceste evenimente sau dacă acestea sunt legate de afecțiunile de bază ale pacienților sau de alți factori.
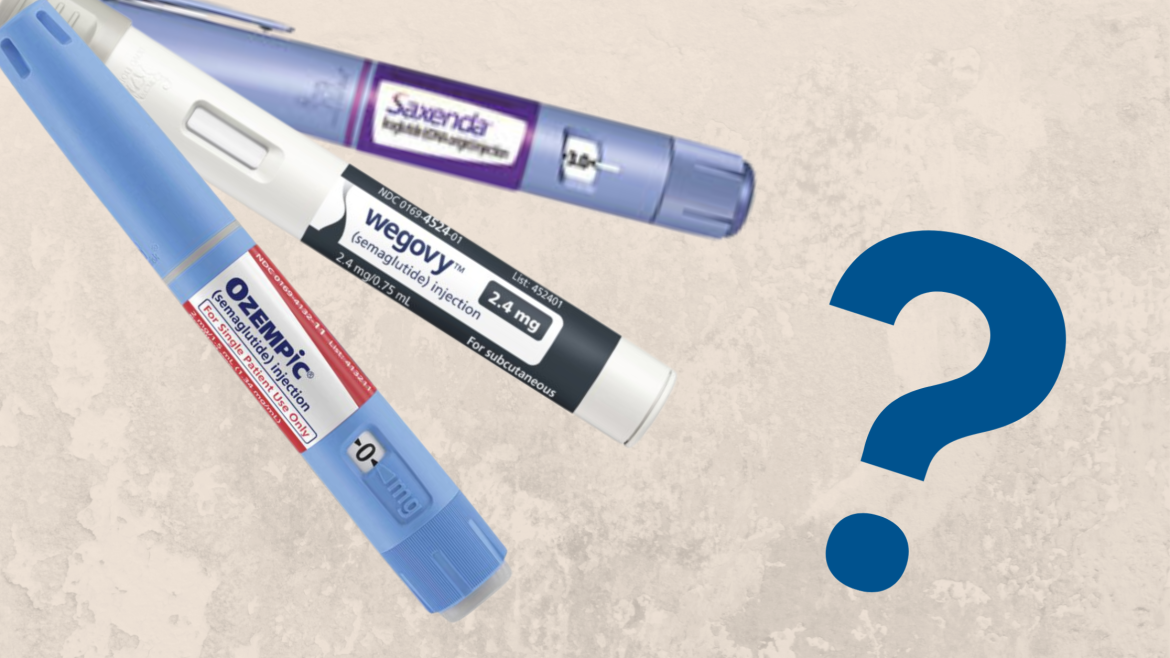
Ozempic și Saxenda
Primele trei cazuri au fost raportate în rândul persoanelor care au luat Ozempic, care este aprobat pentru diabetul de tip 2, dar care este utilizat în afara etichetei pentru pierderea în greutate, și Saxenda, autorizat pentru pierderea în greutate, a declarat luni EMA.
EMA a precizat că investigația a fost deschisă la 3 iulie și se așteaptă ca aceasta să se încheie în noiembrie.
Ozempic conține substanța activă semaglutide, care este, de asemenea, substanța activă din medicamentul său-frate, Wegovy, care este autorizat pentru pierderea în greutate. Saxenda conține o substanță activă similară, numit liraglutidă. Toate trei sunt fabricate de Novo Nordisk, cel mai mare producător de medicamente pentru diabet din lume.
Compania a declarat luni pentru CNN că „siguranța pacienților este o prioritate absolută” și că ia „foarte în serios toate rapoartele privind evenimentele adverse legate de utilizarea medicamentelor” sale.
Un comitet de siguranță al EMA analizează evenimentele adverse semnalate de Agenția Islandeză pentru Medicamente, inclusiv două cazuri de gânduri suicidare potențial legate de Ozempic (semaglutidă) și Saxenda (liraglutid), a declarat autoritatea de reglementare.
Un alt pacient care lua liraglutid a raportat gânduri de automutilare, a precizat agenția.
Revizuirea vine la câteva săptămâni după ce autoritatea de reglementare a semnalat îngrijorări privind cancerul tiroidian, în legătură cu mai multe produse ale grupului farmaceutic danez, care conțin semaglutidă, ingredientul activ utilizat în medicamentul pentru diabet Ozempic și în tratamentul pentru obezitate Wegovy (semaglutidă).
“Comportamentul suicidar nu este listat ca efect secundar în informațiile de produs”
EMA notează că, în prezent, comportamentul suicidar nu este listat ca efect secundar în informațiile de produs din Uniunea Europeană pentru medicamente.
Efectele secundare au zădărnicit mai multe încercări anterioare ale industriei farmaceutice de a dezvolta medicamente profitabile pentru scăderea în greutate.
De exemplu, mdicamentul Acomplia (rimonabant) de la Sanofi, care a fost conceput pentru a modifica părți ale sistemului nervos care reglează pofta de mâncare, nu a obținut niciodată o aprobare în Statele Unite, și a fost retras în Europa în 2008, după ce a fost asociat cu gânduri suicidare.
Noile medicamente pentru pierderea în greutate, cum este și semaglutida, reglează pofta de mâncare prin imitarea unui hormon intestinal și nu interferează direct cu chimia creierului.
Luni, EMA a declarat că va analiza dacă revizuirea ar trebui extinsă pentru a include și alte medicamente din aceeași clasă cunoscută sub numele de agoniști ai receptorilor GLP-1, indicate în tratamentul diabetului zaharat de tip 2.
Siguranța pacienților este o prioritate absolută, iar compania ia foarte în serios toate rapoartele privind evenimentele adverse, a declarat grupul danez.
Datele privind siguranța nu au arătat nicio „asociere cauzală” între gândurile suicidare sau de autoagresiune și medicamente, a adăugat acesta.
Toate acestea fac parte dintr-o clasă cunoscută sub numele de agoniști ai receptorilor GLP-1, care include și medicamentul pentru diabet de tip 2 Mounjaro, produs de Eli Lilly – utilizat, de asemenea, în afara etichetei pentru pierderea în greutate, în timp ce așteaptă autorizația de reglementare pentru această utilizare.
EMA a declarat miercuri pentru CNN că revizuirea siguranței medicamentoase nu include tirzepatida, substanța activă din Mounjaro, deoarece acesta vizează un al doilea hormon, GIP, pe lângă GLP-1. Revizuirea cuprinde semaglutida, liraglutida, lixisenatida, dulaglutida și exenatida.
Se recomandă monitorizarea pacienților
Informațiile de prescriere din SUA pentru Saxenda includ o recomandare de monitorizare a pacienților pentru depresie sau gânduri sinucigașe și de întrerupere a tratamentului dacă apar simptome.
Studiile clinice la adulți au constatat că nouă persoane care au luat medicamentul, din peste 3.300, au raportat idei suicidare, comparativ cu două persoane din peste 1.900 care au luat un placebo.
Un adult care lua Saxenda a încercat să se sinucidă, se arată în informațiile de prescriere. În studiile clinice pediatrice, o persoană care lua Saxenda a murit prin sinucidere, din 125 studiate. Informațiile de prescriere spun că „nu au existat informații suficiente pentru a stabili o relație de cauzalitate cu Saxenda”.
Nu există o avertizare similară în informațiile de prescriere din SUA pentru Ozempic, deși informațiile pentru Wegovy notează că în studiile clinice cu alte produse de control al greutății au fost raportate comportamente și idei suicidare și spune că pacienții trebuie monitorizați pentru depresie, gânduri sau comportamente suicidare sau orice modificări neobișnuite ale dispoziției sau comportamentului.
Ce spun americanii
Administrația americană pentru alimente și medicamente a declarat luni pentru CNN că „evaluează în mod obișnuit rapoartele individuale de evenimente adverse și rapoartele de evenimente adverse din literatura de specialitate publicată pentru toate medicamentele aprobate” și nu comentează cercetările efectuate de terți sau rapoartele individuale „ca o chestiune generală”.
Agenția a precizat că continuă să monitorizeze siguranța medicamentelor după aprobare și că are un sistem de programe de supraveghere și de evaluare a riscurilor, iar dacă sunt identificate noi semnale de siguranță, va stabili ce măsuri trebuie luate.
Istoric
În 2008, medicamentul pentru pierderea în greutate Acomplia, produs de producătorul francez de medicamente Sanofi, a fost retras de pe piața europeană din cauza preocupărilor legate de gândurile suicidare. Medicamentul, care funcționează într-un mod diferit de medicamentele GLP-1, nu a fost niciodată autorizat în SUA.
Aceste medicamente mai noi pentru pierderea în greutate au crescut în popularitate. Ele funcționează prin imitarea efectelor unui hormon de reglare a apetitului numit GLP-1. Acestea stimulează eliberarea de insulină, care ajută la scăderea glicemiei, și încetinesc trecerea alimentelor prin intestin. FDA a aprobat semaglutida pentru diabet ca Ozempic în 2017 și pentru pierderea în greutate ca Wegovy în 2021.
Medicamentele au efecte secundare gastro-intestinale cunoscute, cum ar fi greața, vărsăturile și diareea.
Sursa CNN



Comentariile sunt oprite pentru acest articol